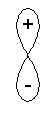
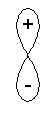
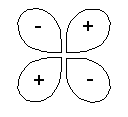
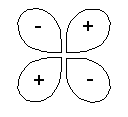
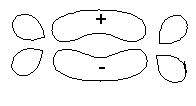

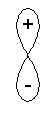 |
+ | 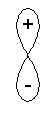 |
 |
|
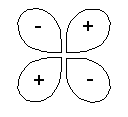 |
+ | 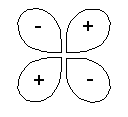 |
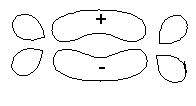 |
|
| + |  |
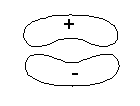
exemplos de sobreposição positiva de
orbitais atômicos dando origem à orbitais
moleculares ligantes
Quando ocorre a formação de um orbital molecular ligante,
ocorre a diminuição da energia do sistema, o que explica a
existência de um novo orbital, um molecular, no lugar de dois
atômicos.
Para a molécula mais simples de estudar, H2, o
diagrama de níveis de energia pode ser dado como abaixo.

A formação da molécula de hidrogênio, H2,
é favorável, pois os elétrons provenientes de cada átomo
ocupam o nível mais baixo de energia, o orbital ligante ![]() .
.

Caso o orbital ![]() ,
que é o orbital molecular anti-ligante, estivesse preenchido, a
molécula não existiria. E isso é o que ocorre com o He2,
uma molécula que existe em condições normais, pois o prbital
anti-ligante está preenchido, o que faz com que a energia não
seja favorável para a estabilidade da molécula, o que não
favorece sua existência, sendo "preferido" pelos
átomos de He, se manterem isolados.
,
que é o orbital molecular anti-ligante, estivesse preenchido, a
molécula não existiria. E isso é o que ocorre com o He2,
uma molécula que existe em condições normais, pois o prbital
anti-ligante está preenchido, o que faz com que a energia não
seja favorável para a estabilidade da molécula, o que não
favorece sua existência, sendo "preferido" pelos
átomos de He, se manterem isolados.
Para uma abordagem mais aprofundada no assunto, Teoria dos
Orbitais Moleculares, TOM, visite o site:
http://inorgan221.iq.unesp.br/quimgeral/metaltr/mo_orb.htm
Neste endereço, o assunto, TOM, é tratado de uma forma mais quantitativa.