|
TOM - Teoria do Orbital Molecular
O movimento de um elétron pode ser
representado por uma função de onda e isso é feito,
encontrando soluções aceitáveis ao resolver a equação de
Schröedinger independente do tempo para o átomo de hidrogênio.
No entanto, a equação de Schröedinger não consegue ser
resolvida para átomos multieletrônicos ou para moléculas e
isso causou a procura de outros métodos para a solução e
explicação da formação de moléculas.
|
Um método simples de se explicar algumas
moléculas é a sobreposição de orbitais atômicos, dando
origem à um novo, um orbital molecular.
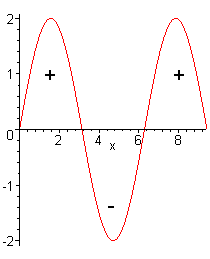
Teoria do Orbital Molecular, TOM, considera o comportamento
ondulatório do elétron, ou seja, o seu comportamento como onda.
Exemplo:
 |
+ |  |
 |
|
| interferência construtiva |
 |
+ |  |
 |
|
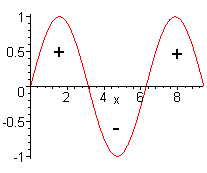
| interferência destrutiva |
Quando duas ondas se sobrepõem
construtivamente, temos a formação de um orbital molecular
ligante.
Quando as ondas se interagem destrutivamente, ocorre a formação
de um orbital molecular anti-ligante.
No momento em que os orbitais atômicos se aproximam, dando
origem à um orbital molecular ligante, temos que a densidade
eletrônica aumenta na região entre núcleos.
 |
+ |  |
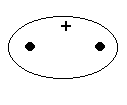 |
Quando os orbitais se aproximam dando origem à um orbital anti-ligante, a densidade eletrônica na região entre os núcleos diminui.
 |
+ |  |
 |
O fato da sobreposição ser positiva ou negativa é devido ao sinal das funções de onda dos elétrons envolvidos.