Na região do infravermelho distante, compreendida entre 400 - 10 cm-1, utiliza-se hoje uma técnica distinta, a chamada espectroscopia por transformada de Fourier, baseada em medições interferométricas. Esta técnica está se generalizando cada vez mais, inclusive nas outras regiões do infravermelho. Nesta região aparecem as bandas de absorção devidas à rotação de moléculas leves, assim como os movimentos reticulares em cristais.
Uma maneira indireta de se observar os espectros vibracionais, transferindo para a região do visível as informações que seriam normalmente obtidas no infravermelho, é através do espalhamento Raman, ou seja, do espalhamento inelástico de radiação eletromagnética monocromática que interage com as moléculas. As freqüências vibracionais são determinadas pelas diferenças entre as freqüências das radiações espalhadas e a da radiação incidente.
Fisicamente os dois processos, Raman e infravermelho, são diferentes. A absorção no infravermelho ocorre quando a freqüência da radiação, multiplicada pela constante de Planck, tem o mesmo valor da diferença de energia entre dois estados vibracionais, ou seja, o processo envolve uma ressonância entre a diferença de níveis de energia da molécula e a radiação eletromagnética. No espalhamento Raman, uma radiação no visível ou ultravioleta interage com a molécula e é espalhada com freqüência ligeiramente modificada. Esta variação de freqüência corresponde a diferença de energia entre dois estados vibracionais. Considerando os mesmos estados vibracionais, a freqüência Raman seria a mesma do infravermelho, no entanto, para um modo vibracional ser ativo no infravermelho é necessário que haja variação no momento dipolar durante esta vibração, enquanto que a atividade no Raman difere no sentido de que o momento de dipolo a ser considerado é o induzido pela radiação eletromagnética, isto é, deve haver variação da polarizabilidade da molécula durante a vibração.
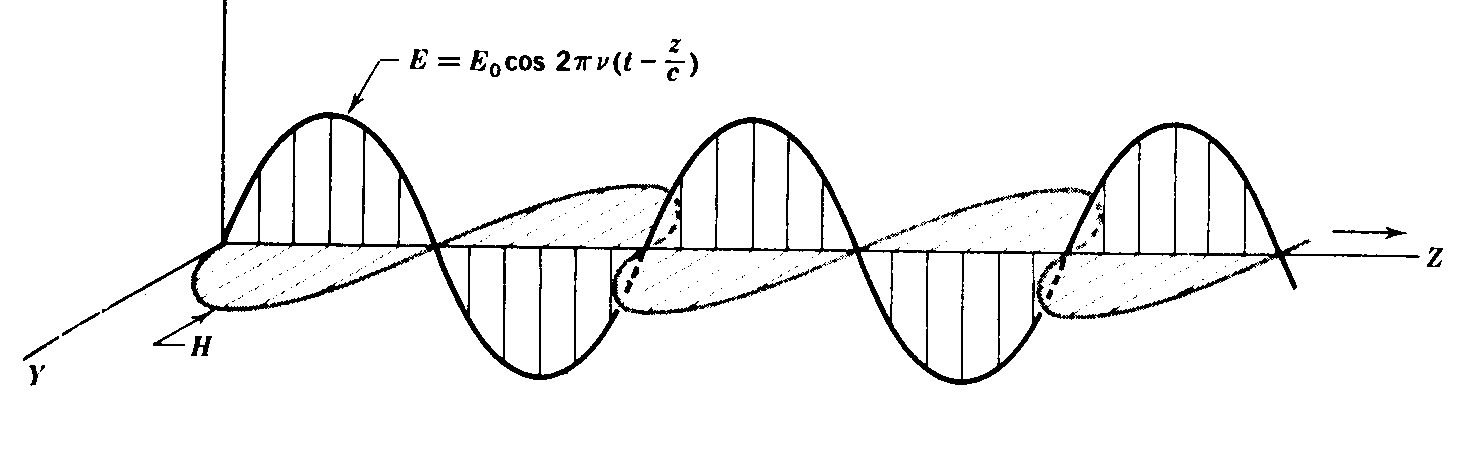
As radiações infravermelhas, como todas as radiações eletromagnéticas, são compostas de um movimento ondulatório entre dois campos oscilantes, elétrico e magnético, de mesma freqüência e perpendiculares entre si (FIGURA 1).

FIGURA 1 - Radiação Eletromagnética Plano-Polarizada
A equação 2 ilustra a relação entre a freqüência de oscilação n ' e o comprimento de onda l de uma radiação eletromagnética, onde c é a velocidade da luz:
|
(2) |
Como a freqüência da radiação infravermelha alcança números da ordem de 1012 a 1014 Hz, é conveniente caracterizá-la através do número de onda, representada por n e expressa em cm-1. n é o inverso de l , ou seja:
|
(3) |
O número de onda é muitas vezes chamado de freqüência por ser proporcional a verdadeira freqüência:
|
(4) |
Os sistemas microscópicos se caracterizam por valores descontínuos de energia: os níveis energéticos. A transição entre dois níveis distintos, E1 e E2, possibilita a emissão ou absorção de radiação, de acordo com a relação Planck - Bohr:
D E = E2 - E1 = h.n ' = h.c.n ; E2 > E1 |
(5) |
onde h é a constante de Planck.
Uma molécula não é uma estrutura rígida, pois os seus átomos oscilam ou vibram em torno de suas posições de equilíbrio e a amplitude destas oscilações é pequena e varia entre 0,01 e 0,1 Å, mas as suas freqüências de vibração são relativamente elevadas e da ordem da freqüência da radiação infravermelha, havendo assim a possibilidade de interações entre a última e as primeiras .
O registro gráfico da porcentagem de radiação absorvida ou transmitida por uma amostra em função do comprimento de onda ou do número de ondas da radiação infravermelha incidente é chamado de espectro infravermelho. A região do espectro onde aparece absorção de radiação chama-se banda de absorção e a freqüência ou número de ondas do pico de absorção máxima denomina-se de freqüência da banda, sendo a sua intensidade ou porcentagem de absorção, dados de grande interesse quanto ao estudo da estrutura molecular .