INTERAÇÕES DE LEWIS EM SOLVENTES NÃO POLARES
De grande interesse corrente são as tentativas de calcular e correlacionar as forças de ácidos e bases de Lewis. Muitas delas tem sido medidas em fase gasosa e muita mais em solventes não polares, apróticos, nos quais, espera-se que.os efeitos do solvente sejam minimizados. Há vários métodos disponíveis para cálculo das forças de ácidos e bases.
É comum igualar a extensão da interação de um ácido e de uma base com a entalpia da reação. Em alguns casos esta entalpia é medida por calorimetria direta: D H igual a "q" para um processo adiabático a pressão constante.
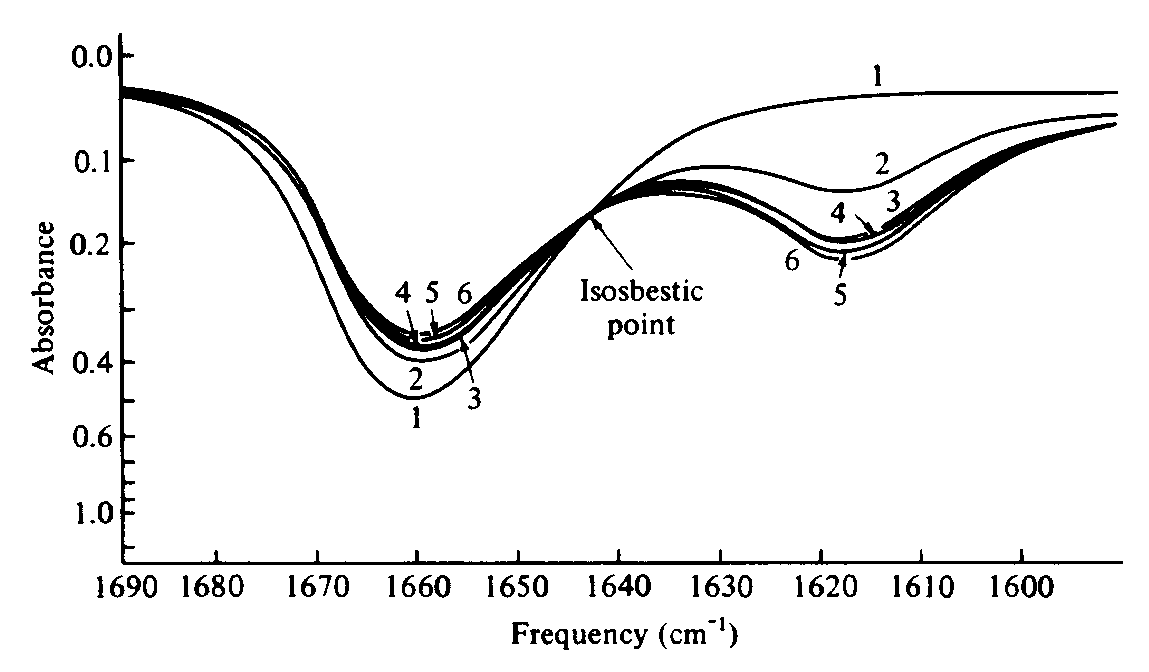
Muitas vezes a entalpia da reação é obtida pela medida da constante de equilíbrio de uma reação ácido-base sobre um intervalo de temperatura. Se for traçado o gráfico de ln K contra 1/T, a inclinação será igual a -D H/R. Assim, vários métodos experimentais têm sido propostos para medir a constante de equilíbrio por métodos espectroscópicos. Qualquer absorção diferente das absorções dos reagentes (do ácido ou da base) e do aduto ácido-base é uma fonte potencial de informação da magnitude da constante de equilíbrio que dá a concentração de duas das três espécies envolvidas no equilíbrio diretamente e a terceira indiretamente, a partir do conhecimento da estequiometria da reação. Por exemplo, considere a reação extensivamente estudada entre compostos orgânicos de carbonila e iodo. A freqüência de absorção no infravermelho da carbonila tem um deslocamento de freqüência no aduto com relação ao composto de carbonila livre (Figura 3). Assim, a mistura em equilíbrio mostra duas bandas de absorção na região da carbonila no espectro e pode-se obter as concentrações relativas da carbonila livre e do aduto. Alternativamente, pode-se observar a absorção da molécula de iodo, I2, em 300-600 nm, na região visível. De novo, o aduto absorve em uma freqüência diferente do iodo livre e os dois máximos de absorção dão informação acerca das concentrações relativas das espécies presentes.

Figura 3 - Espectro de absorção na região do infravermelho do sistema iodo-dimetilacetamida:
(1) somente dimetilacetamida; (2-6) concentrações crescentes de iodo.
Pico a 1662 cm-1 é da dimetilacetamida livre, o que está em 1619 cm-1 é do aduto DMA.I2.
Duas complicações podem impedir uma determinação simples da concentração de cada espécie em uma medida de absorbância na freqüência escolhida. Embora a maioria das reações ácido-base de interesse resulte em uma estequiometria um para um, não se pode assumir isto a priori, e adutos dois para um e três para um também podem estar presentes. Felizmente, este é geralmente um ponto fácil de ser resolvido. A presença de um ponto isosbéstico ou ponto de absorção constante (Figura 3) é geralmente um critério confiável de que apenas duas espécies absorventes (o ácido ou a base livre e um único aduto) estão presentes.
O segundo problema é um pouco mais difícil. A separação entre o máximo de absorção do aduto e do ácido (ou da base) livre raramente é grande e assim há considerável sobreposição de bandas. Se as absortividades (e ) de cada espécie, em cada freqüência, fossem conhecidas, seria simples atribuir uma proporção da absorbância total em uma dada freqüência a cada espécie. Geralmente é relativamente simples medir a absortividade de um ácido (ou base) livre na região de trabalho. Como freqüentemente é impossível preparar o aduto puro (na ausência de concentrações de equilíbrio de ácido e da base livres), sua absortividade não pode ser medida. Entretanto, se o equilíbrio é estudado em duas concentrações diferentes de ácido (ou base), é possível estabelecer duas equações simultâneas em termos de duas incógnitas K e e e resolvê-las.
Métodos alternativos, de medidas de entalpia de reações ácido-base, envolvem medidas de alguma propriedade física que dependa da força da interação. Em geral, estes métodos devem ser calibrados com relação a um dos tipos prévios de medidas, mas uma vez feito, ele pode muitas vezes ser estendido para reações que dificilmente podem ser medidas por outros meios. Um exemplo é o estudo de fenol como um ácido de Lewis. Fenol forma ligações de hidrogênio fortes com bases de Lewis, especialmente as que têm um átomo doador com carga negativa alta. A formação da ligação de hidrogênio altera a densidade eletrônica do grupo O-H do fenol e a freqüência de estiramento do grupo OH na região do infravermelho. Uma vez que as freqüências de uma série de adutos fenol-base foram usadas para calibração (Figura 4), é possível estimar a entalpia de formação do aduto de bases com grupos funcionais similares diretamente a partir dos espectros de absorção na região do infravermelho.
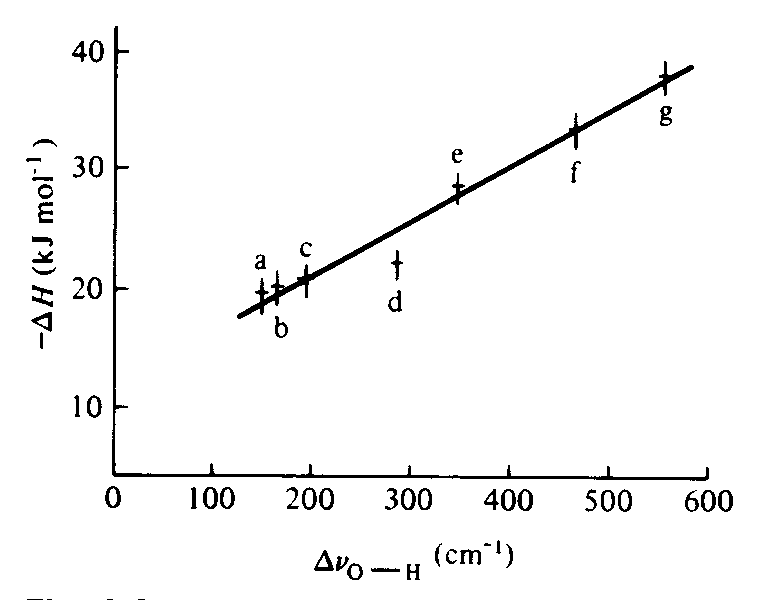
Figura 4 - Relação entre a entalpia de formação de adutos base-fenol
e freqüências de estiramento da ligação O-H no fenol.
Bases: (a) acetonitrila, (b) acetato de etila, (c) acetona, (d) tetrahidrofurano,
(e) dimetilacetamida, (f) piridina, (g) trietilamina.
Um segundo método envolve a relação entre o caráter s e as constantes de acoplamento de RNM. Drago e colaboradores, mostraram que há uma boa correlação entre as constantes de acoplamento de 119Sn-H em adutos de clorotrimetilestanho-base e a força da ligação estanho-base. Sugeriram que as bases mais fortes forçam o estanho a re-hibridizar até uma extensão maior (@ sp3 no Me3SnC
l livre, @ sp3d no limite do aduto de base forte) que as mais fracas e a mudança no caráter s das ligações Sn-C é refletida nas constantes de acoplamento.