R3N
+
2 H2O
![]()
OH-
+
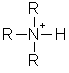
(46)
EFEITOS DE SOLVATAÇÃO E "ANOMALIAS" ÁCIDO - BASE
Deve-se considerar a tensão-F e a tensão-T, ou ambas, como responsáveis pelo comportamento não usual da redução de basicidade em trialquilaminas quando comparada com amônia e aminas mono- e bi- substituídas. A adição de três grupos alquila deve criar problemas estéricos para um átomo de nitrogênio pequeno. A tensão-F não pode ser responsável pela redução de basicidade de aminas terciárias, pois os valores de pKa são medidos em solução aquosa e representam o equilíbrio:
|
R3N |
+ |
2 H2O |
|
OH- |
+ |
|
(46) |
e o próton que está sendo adicionado à base não tem requisitos estéricos por ser muito pequeno. Entretanto, a tensão-T pode estar envolvida, pois ela resulta de tensão intramolecular em uma molécula particular e esta explicação tem sido dada por conta do decréscimo da basicidade de trialquilaminas. Neste aspecto é interessante o fato de que se as basicidades de metilaminas forem medidas em fase gasosa, elas aumentam regularmente na ordem NH3 < H3CNH2 < (H3C)2NH < (H3C)3N. Portanto a "anomalia" da basicidade da trimetilamina deve estar em algum efeito de solução. A solvatação através da ligação hidrogênio tenderá a aumentar a força aparente de todas as aminas porque os íons amônio, carregados positivamente, serão solvatados mais extensivamente. (D H de dez a cem vezes maior) do que as aminas não carregadas. Assim, a basicidade das aminas é aumentada em proporção à extensão da solvatação do íon amônio conjugado e as energias de solvatação são RNH3+ > R2NH2+ > R3NH+. Este é o inverso da ordem de aumento de basicidade que resulta de efeitos eletrônicos (indutivos). Duas tendências opostas não lineares darão um máximo e um mínimo. Portanto não é surpresa encontrar um máximo de basicidade (medida em solução aquosa) para dialquilaminas.
|
R3N |
+ |
2 H2O |
|
OH- |
+ |
|
(47) |
|
RNH2 |
+ |
4 H2O |
|
OH- |
+ |
|
(48) |
Quando estas reações são analisadas pelo ciclo de Born-Haber, o efeito de solvatação pode ser facilmente notado. Quando cada ligação de hidrogênio, do átomo positivo de nitrogênio do íon amônio é substituído por um agrupo alquil, o íon perde aproximadamente 30 kJ mol-1 da energia de hidratação.
Muitas das "anomalias", recentemente verificadas, são históricas: dados experimentais precisos para espécies em solução foram acumulados por décadas e teorias correspondentes foram sendo propostas muito antes de serem coletados os primeiros dados em fase gasosa. Por exemplo, verificou-se que a acidez da água e de álcoois segue a ordem H2O > R(1°)OH > R(2°)OH > R(3°)OH e a explicação dada foi de que grupos alquila liberadores de elétrons aumentam a densidade eletrônica do átomo de oxigênio da base conjugada, tornando-a mais básica. Mas observe que as eletronegatividades de grupos alquila ligados e não ligados são praticamente idênticas, e se houver alguma tendência, os grupos com mais átomos de carbono serão ligeiramente mais eletronegativos: Me = 2,30, Et = 2,32, i-Pr = 2,34, t-Bu = 2,36. Estes grupos diferem entre si significantemente, apenas nas suas capacidades de carga. Assim, grupos altamente ramificados são melhores doadores (quando ligados a centros eletronegativos) e também melhores aceitadores (quando ligados a centros de baixa eletronegatividade). Paradoxalmente o O- é pouco eletronegativo: o átomo de oxigênio será estabilizado se a carga aniônica for deslocalizada. Isto pode ser melhor acompanhado pelos grupos com maiores capacidades de carga. Em relação ao átomo de hidrogênio (1,0), as capacidades de carga dos grupos são Me = 2,8, Et = 3,4, i-Pr = 3,9 e t-Bu = 4,2. O resultado é que em reações de fase gasosa, sem energias de solvatação complicadoras, a ordem de basicidade é OH- > R(1°)O- > R(2°)O- > R(3°)O-.
Então, por que a ordem de basicidade é invertida quando se passa de fase gasosa para solução ? Novamente, efeitos de solvatação vencem efeitos eletrônicos inerentes. Como no caso das aminas, a ligação de hidrogênio é o fator predominante e, conforme crescem as porções orgânicas dos íons, ele aumenta como uma bola de neve. O ânion perde a estabilidade especial de solvatação normalmente usufruída pelas moléculas neutras e assim aceita o próton mais facilmente. O aumento da basicidade do íon t-butóxido ocorre, não por causa de maior densidade eletrônica no oxigênio (ela é menor), mas porque falta ao ânion a estabilização da solvatação.
Apesar de algumas dissonâncias com "regras" aprendidas em cursos anteriores, é óbvio que a melhor medida da basicidade, inerente de uma espécie, é sua afinidade protônica em fase gasosa. Ela é definida como a entalpia da reação:
|
B(g) |
+ |
B'H+(g) |
|
BH+(g) |
+ |
B'(g) |
(49) |
Ela pode ser obtida por uma técnica conhecida como espectroscopia de ressonância ciclotrônica iônica e por métodos relacionados com ela, que medem a competição de duas bases por um próton em fase gasosa. Portanto não é afetada por efeitos de solvatação. Até recentemente poucos dados deste tipo eram disponíveis, mas a técnica tem sido usada atualmente com bastante sucesso, numa ampla variedade de compostos.