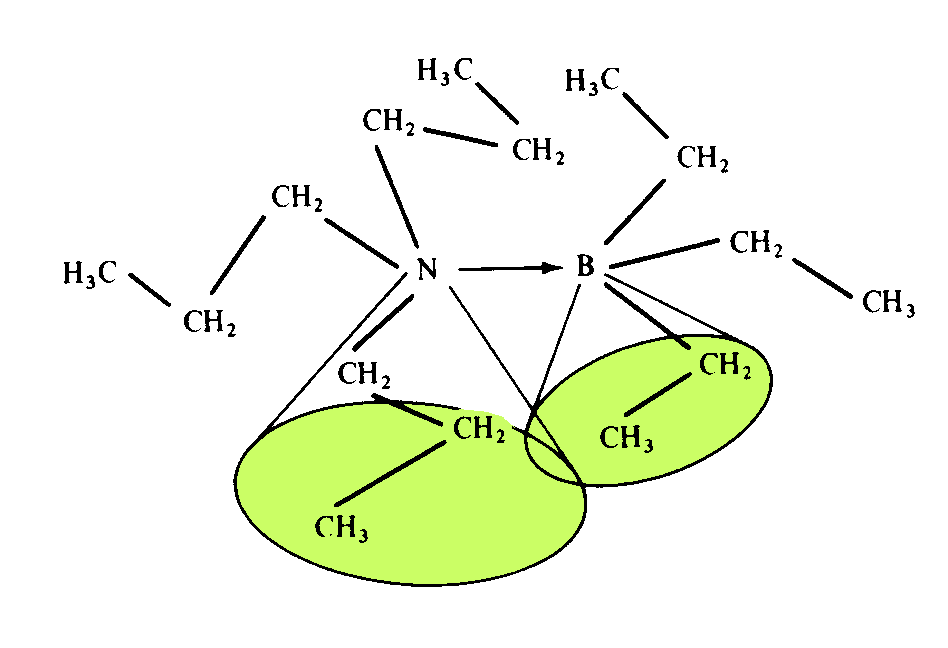
EFEITOS ESTÉRICOS
Nas reações entre ácidos e bases de Lewis, como aminas e boranos ou haletos de boro, substituintes volumosos em uma ou todas as espécies podem afetar a estabilidade de adutos ácido-base. Talvez o tipo mais direto de efeito seja o impedimento estérico simples entre substituintes de um átomo de nitrogênio e substituintes volumosos similares do átomo de boro. A Figura 1 mostra um esquema de um aduto entre moléculas de tripropilamina e trietilborano. Este fenômeno é conhecido como "pressão-F" ou frontal e pode ter um considerável efeito sobre a estabilidade do aduto, uma vez que os grupos alquilas tendem a varrer volumes grandes por fazerem rotação aleatória.

Figura 1 - Aduto de tripropilamina-trietilborano ilustrando o impedimento estérico
entre os substituintes volumosos nos átomos de nitrogênio e boro.
Um segundo efeito, similar, é conhecido como "pressão-T" ou traseira. Resulta de uma necessidade estrutural dos átomos de nitrogênio das aminas de serem aproximadamente tetraédricos (sp3) para efetivamente se ligarem pelo par isolado. Se os grupos alquila do átomo de nitrogênio forem suficientemente volumosos, presumivelmente eles podem forçar os ângulos de ligação das aminas a abrirem, aumentando o uso de caráter s nestas ligações e mais caráter p é deixado para o par isolado. O resultado extremo é a formação de uma molécula trigonal plana, com o par isolado em um orbital p puro, pouco capaz de doação para um ácido (Ver Figura abaixo).

Figura 2 - Aminas substituídas com tensão traseira.
a) Substituintes pequenos, sem tensão, boa base;
(b) tensão moderada devido a substituintes de tamanho moderado e alguma hibridização;
(c) substituintes extremamente volumosos, o átomo de nitrogênio é forçado a uma hibridização plana, sp2 + p, base fraca.
Relacionada com a tensão traseira, mas menos compreendida, está a tensão-I (interna). Em aminas cíclicas e éteres como (CH2)nO, a basicidade varia com o tamanho do anel. Nestes compostos a hibridização (e assim a eletronegatividade e a capacidade de sobreposição) não somente do centro básico (N, O, etc) mas também dos átomos de carbono no anel, vão variar com o tamanho do anel, e não haverá uma regra simples para prever os resultados.
Quando o centro básico é um exociclo, como as lactamas, lactonas, etc, os resultados podem ser interpretados de um modo direto, análogo ao argumento usado anteriormente para bifenileno. Considere a série de lactamas:
|
|
> |
|
> |
|
Como o tamanho do anel é reduzido, os ângulos de ligação internos devem ser reduzidos e a hibridização de átomos cíclicos tem menos caráter s e eletronegatividade mais baixa. Devido ao átomo de oxigênio exocíclico, o centro básico, o átomo de carbono do ciclo deve mostrar caráter s maior e eletronegatividade mais alta. Os grupos carbonila em compostos com anéis pequenos são portanto, menos básicos.