CsI
+
LiF
![]()
LiI
+
CsF
(63)
ELETRONEGATIVIDADE E DUREZA E MOLEZA
Em geral, espécies com eletronegatividade relativamente altas são duras e aquelas com eletronegatividade baixas são moles. Deve-se lembrar que estamos considerando íons e que embora Li, por exemplo, tenha eletronegatividade baixa, o íon Li+ tem eletronegatividade relativamente alta, devido ao segundo potencial de ionização extremamente alto. Ao contrário, metais de transição em estados de oxidação baixos (Cu+, Ag+, etc) têm energias de ionização relativamente baixas e baixas eletronegatividades. O mesmo pode ser dito de bases duras e moles. Esta relação entre dureza e eletronegatividade ajuda a explicar o fato do grupo trifluormetila ser consideravelmente mais duro que o borano.
Pearson chamou a atenção para uma anomalia interessante entre a regra dos ácidos e bases duros e moles e o método original de Pauling de definição de eletronegatividade. De acordo com este último, a energia de ressonância iônica é proporcional ao quadrado da diferença de eletronegatividade entre os átomos constituintes. Literalmente, isto implicaria que quanto maior a estabilização que ocorre quando as ligações entre os elementos são formadas, maior a diferença de eletronegatividade, como em césio e fluoreto. Pode-se então prever a seguinte reação baseada na pressuposta estabilidade dominante resultante da energia de ressonância iônica Cs-F:
|
CsI |
+ |
LiF |
|
LiI |
+ |
CsF |
(63) |
Experimentalmente verificou-se que o inverso é verdade - que a reação ocorre realmente:
|
LiI |
+ |
CsF |
|
LiF |
+ |
CsI |
D H = ~ -63 kJ mol-1 |
(64) |
Observe entretanto que a regra de ácido - base duro - mole funciona: as duas espécies mais duras (Li+, F-) preferem uma à outra a as duas espécies mais moles (Cs+, I-) também se preferem mutuamente.
A análise deste aparente paradoxo pode ser abordada em dois níveis. O mais simples é olhar os calores de atomização dos quatro compostos da primeira equação: LiF = +573, CsF = +502, LiI = +347, CsI = +335 (kJ mol-1). Embora a interação duro-duro (LiF) forme a ligação mais forte como esperado, a interação mole-mole é a menos estável. Parece que a força diretora na segunda reação é a interação duro-duro e que isto faz a reação ocorrer para a direita, apesar da fraca interação mole-mole prejudicar. Pode-se obtemperar que a segunda reação representa espécies predominantemente iônicas, nas quais as interações mole-mole "covalentes" não podem ocorrer, os mesmos resultados podem ser obtidos considerando as reações envolvendo espécies mais típicas mole-mole:
|
HgF2 |
+ |
BeI2 |
|
BeF2 |
+ |
HgI2 |
D H = -397 kJ mol-1 |
(65) |
|
mole-duro |
duro-mole |
duro-duro |
mole-mole |
Os calores de atomização das espécies envolvidas são: BeF2 = +1264; HgF2 = +536; BeI2 = +578; HgI2 = +291 (kJ mol-1). A força diretora da reação ilustrada na Equação 65 consiste quase em sua totalidade das altas energias de ligação no BeF2, portanto, somos levados a crer que, pelo menos nestes exemplos, que a energia presumivelmente eletrostática da interação duro-duro é a principal força diretora.
Um exame mais profundo da situação envolve uma tentativa de partição da energia de ligação de uma molécula entre os vários tipos de energia: "covalente", "iônica", etc. Obviamente esta abordagem é um tanto artificial, mas como os químicos estão acostumados a pensar em termos destas energias, este tratamento pode ajudar a ilustrar o problema criado pelo "paradoxo de Pearson - Pauling".
Em um primeiro passo, podemos considerar as ligações que são completamente covalentes (no sentido em que ambos os átomos têm carga parcial zero). A Figura 6 contem um gráfico das energias de algumas ligações homopolares comuns contra as suas distâncias. O fator que mais se destaca nestes dados é a notável correlação entre energia e distância de ligação. Em geral, átomos pequenos formam ligações covalentes fortes e átomos grandes formam ligações covalentes mais fracas. Exceções aparentes a esta tendência são as ligações fracas O-O, N-N e F-F. Nestas moléculas, pares isolados em átomos pequenos e adjacentes causam repulsões fortes. Se não fossem estas repulsões as energias destas ligações seriam cerca de 350 - 400 kJ mol-1. Como evidência de que a relativa instabilidade destas ligações resulta de repulsões entre pares isolados e não de alguma fraqueza inerente na habilidade de formação de ligações destes átomos, pode-se observar que a ligação tripla Nº N é mais forte (941 kJ mol-1) e mais curta (109,8 pm) que a ligação tripla Cº C (837 kJ mol-1; 120 pm), como esperado. Deve-se notar que mesmo ligações entre átomos maiores contendo pares de elétrons isolados (Cl, S, Br, etc) são um pouco mais fracas que entre átomos comparáveis sem repulsões entre pares isolados (Si, Ge, Sn), embora presumivelmente as repulsões relaxem com o aumento da distância entre os átomos que se ligam.
Os dados da Figura 6 indicam que a interpretação das interações duro-duro (ligações entre átomos pequenos) como puramente eletrostáticas e entre átomos maiores (interações mole-mole) como ligações covalentes fortes não é precisa. A ligação covalente é mais forte entre átomos pequenos que permitem uma boa sobreposição (a ligação homopolar mais forte é H-H, 431 kJ mol-1).
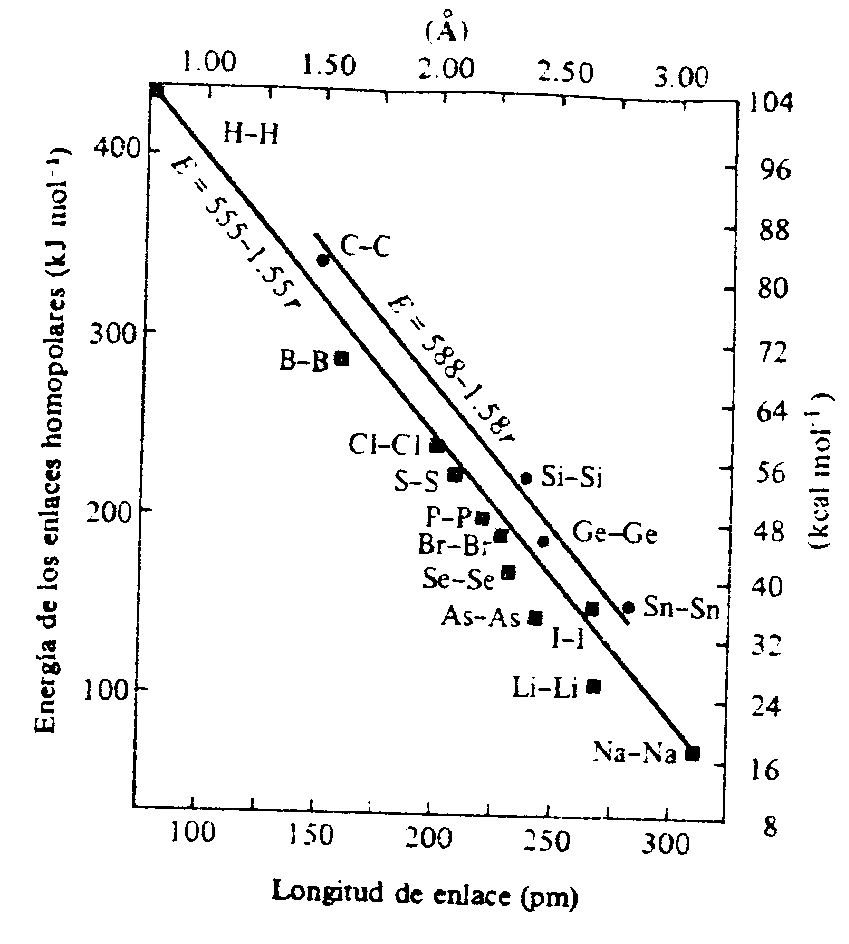
Figura 6 - Relação entre energia e distância de ligação para ligações homopolares.
A linha superior é somente para elementos do Grupo 14, a linha inferior é para o conjunto todo.
Ao estimar as contribuições para as energias de ligação em uma molécula (ou par iônico) como o LiF, devemos considerar a possibilidades destes dois átomos poderem formar uma ligação covalente forte, assim como a possibilidade de estabelecerem uma atração de Madelung forte (em um par iônico Li+F-). Isto não deve implicar que o fluoreto de lítio possa formar uma ligação covalente além de uma ligação iônica, mas ao invés dela, se for energeticamente mais factível, ou de forma mais real, uma ligação com caráter parte iônico e parte covalente, o que maximiza a energia da ligação. Tentativas de calcular as importâncias relativas destes dois métodos de ligação são somente aproximadas, mas indicam que cada uma contribui em apreciável extensão para o LiF.
Da energia total da ligação LiF (573 kJ mol-1), aproximadamente um quarto vem da ligação covalente, metade da atração de Madelung (eletrostática) entre as cargas parciais dos átomos de Li e F (aproximadamente dois terços da carga eletrônica) e cerca de um quarto vem da transferência de carga parcial do átomo de lítio - menos eletronegativo - para o átomo de flúor, mais eletronegativo (isto corresponde grosseiramente à energia de ressonância iônica de Pauling).
O princípio de ácidos e bases duros e moles (ABDM) e o sistema EAEB-CACB foram propostos e desenvolvidos nos anos 60. Assim, como o princípio de ABDM emprega as noções de ligação eletrostática e covalente ao considerar dureza e moleza, é natural tentar uma correlação com os parâmetros E e C. O início dos anos 70 mostrou repetidas tentativas de se correlacionar as duas idéias, verificar qual a melhor ou melhorar suas bases teóricas. Por exemplo, Drago e Pearson discutiram a possível quantificação do princípio de ABDM com o sistema E-C, mas chegaram a conclusões diametricamente opostas. Drago sugeriu que o modelo de ABDM não se manteria mais.
Parte das dificuldades encontradas na comparação entre estas duas abordagens resulta dos diferentes modos que têm sido usados. A abordagem E-C trata a interação de somente duas espécies de cada vez; tanto que quando são usados solventes não polares nestes estudos, os efeitos de solvatação são minimizados e os resultados são comparáveis às afinidades protônicas em fase gasosa. Ao contrário, o princípio de ABDM é geralmente aplicado nas reações de troca ou de competição do tipo:
|
A1B1 |
+ |
A2B2 |
|
A1B2 |
+ |
A2B1 |
(66) |
Já vimos que em fase gasosa, a estabilidade de todos os haletos metálicos segue a ordem F- > Cl- > Br- > I-, ao contrário da interpretação mais simples possível da regra de ABDM. Talvez este deva ser re-estabelecido como: ácidos moles preferem se ligar a bases moles quando os ácidos duros estão preferencialmente ligados a bases duras. Embora a regra de ABDM funcione em fase gasosa, até agora sua maior utilidade está no entendimento dos complexos em solução aquosa. Estes íons serão sempre hidratados, apesar disto não estar estabelecido explicitamente. Sob estas circunstâncias é surpreendente que a regra de ABDM funcione tão bem. Numa análise recente de ambos os enfoques, ABDM e E-C, concluiu-se que o princípio de ABDM funciona razoavelmente bem quando aplicado a complexação, mas não no conjunto de ácidos e bases de Drago-Wayland.
McDaniel e colaboradores apresentaram um meio gráfico de retratar algumas idéias discutidas neste capítulo. Para a reação de ácidos e bases duros e moles:
|
AdBm |
+ |
AmBd |
|
AdBd |
+ |
AmBb |
(67) |
Pode-se mostrar que a entalpia da ligação desta reação, D Hr, pode ser relacionada com as afinidades das bases para os dois ácidos como mostrado na Figura 7. Se as afinidades para um ácido duro (por ex., H+) e um ácido mole (por ex., CH3+) forem lançadas em gráfico e forem desenhadas por elas, linhas de inclinação um, D Hr,. para a reação pode ser medido pela distância entre as linhas ao longo das direções x ou y. Além disso, se duas bases caírem na mesma linha, elas podem ser igualmente moles. Se a linha para uma dada base está acima de outra, a primeira base será mais mole e a segunda mais dura. Finalmente, como a força está relacionada com a magnitude das interações ácido-base, quanto mais distante uma base está da origem, mais forte ela é.
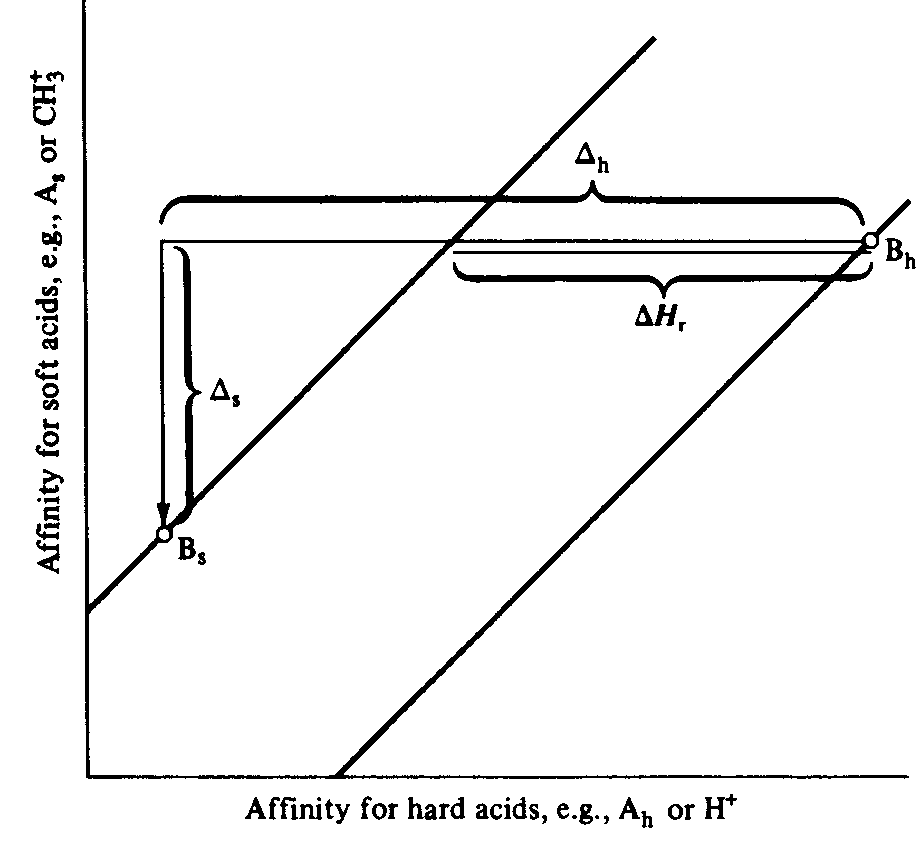
Figura 7 - Diagrama de McDaniel ilustrando os parâmetros ABDM.
No eixo vertical, a afinidade por ácidos moles; no eixo horizontal, a afinidade por ácidos duros. D m é a diferença entre as afinidades das duas bases, Bm e Bd para o ácido mole, A. D d é a diferença entre as afinidades das duas bases, Bm e Bd, para o ácido duro, Ad. A entalpia da reação é dada pela distância horizontal (ou distância vertical) entre as duas linhas de inclinação um.
Algumas bases típicas foram colocadas em um gráfico com suas afinidades protônicas e suas afinidades pelo cátion metil (Figura 8). A linha sólida foi traçada pelos pesquisadores originais como o mínimo quadrado apropriado de todos os dados e a linha tracejada foi adicionada para esta discussão, tomando-se como base os íons F- e OH-, com inclinação unitária. O leitor é compelido a encontrar pares análogos como I- e F-, SH- e H-, CN- e NH2- e interpretar suas posições neste gráfico em termos de força inerente, dureza e moleza.
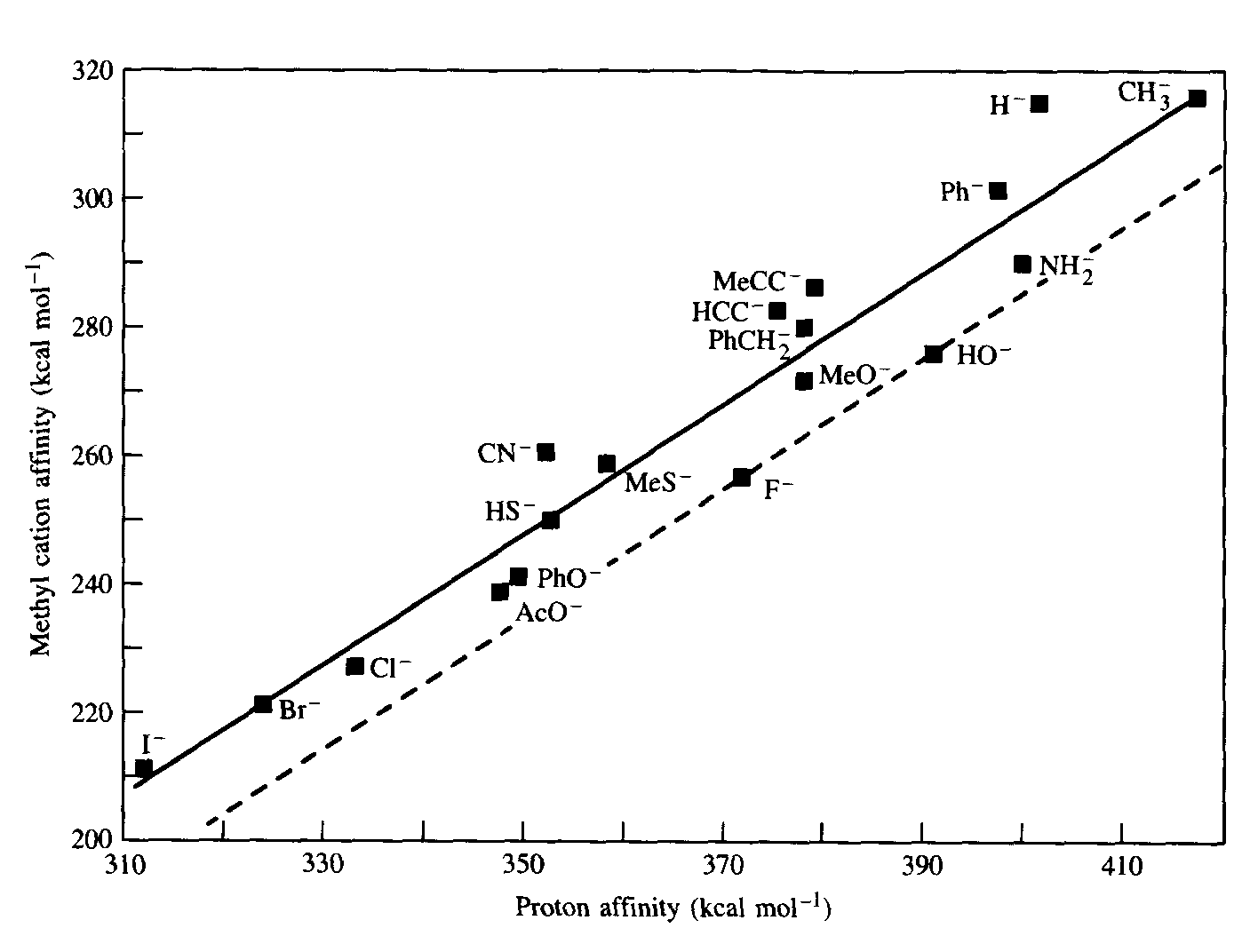
Figura 8 - Afinidade do cátion metálico contra afinidade protônica em espécies neutras.
O cátion metil pode ser considerado um ácido mais mole que o próton.
Recentemente Staley e colaboradores forneceram medidas diretas dos efeitos ABDM em energias de dissociação em fase gasosa entre metais de transição (onde o princípio sempre provou ser útil) e vários ligantes, duros e moles. Como esperado, Cu+ (d10) é significantemente mais mole que Co+ (d8), que por sua vez é mais mole que Mn+ (d6). Outros metais de transição como ferro e níquel mostram resultados similares. Uma comparação destes resultados para Co+ e Mn+ está representada na Figura 9. Há a esperada correlação das energias de dissociação para uma grande série de bases de oxigênio, a variação ao longo da linha resultante de diferenças em substituintes, hibridização, eletronegatividade, etc. Entretanto, tão logo as bases de oxigênio são substituídas por bases mais moles como MeSH, EtSH, Me2S e HCN, uma nova linha é gerada com o íon mais mole Co+ mostrando energias de dissociação ~30 kJ mol-1 maiores. O leitor interessado deve buscar os artigos originais que contêm muito mais dados e figuras interessantes do que pode ser apresentado aqui. Resumindo, todos estes dados são consistentes com o efeito ABDM atuando na ausência de efeitos de solvente complicadores, para estabilizar tanto interações duro-duro como interações mole-mole, ou ambas.

Figura 9 - Energias relativas de dissociação de ligantes para Mn+ e Co+.
Pontos zero para as escalas foram escolhidos arbitrariamente. Observe que para ligantes moles, MeSH, HCN, EtSH e Me2SH, os pontos estão acima e à esquerda dos correspondentes para as bases de oxigênio. Isto indica ligação duro-duro (O-Mn+) ou ligação mole-mole (S-Co+) ou ambas, relativamente mais fortes.
Resumindo, a química de ácido-base é conceitualmente bastante simples mas a multiplicidade de fatores envolvidos faz o tratamento mais elaborado. Até que mais conceitos unificadores sejam desenvolvidos, como sem dúvida acontecerá, será necessário aplicar a cada problema encontrado as idéias, regras e (quando houver) os parâmetros disponíveis para ele.