SO32-
+
HF
![]()
HSO3-
+
F-
Keq = 104
(53)
FORÇA DE ÁCIDO - BASE E DUREZA E MOLEZA
Dureza e moleza se referem em especial à estabilidade das interações duro-duro e mole-mole e devem ser cuidadosamente distinguidas da força ácido-base inerente. Por exemplo, OH- e F- são bases duras; já a basicidade do íon hidróxido é cerca de 1013 vezes a do íon fluoreto. Do mesmo modo, SO32- e Et3P podem ser consideradas bases moles mas a segunda é 107 vezes mais forte (com relação a CH3Hg+). É possível para um ácido ou base forte deslocar o mais fraco, mesmo que isto pareça violar o princípio de ácidos e bases duros e moles. Por exemplo, o íon sulfito, uma base mais forte e mais mole, pode deslocar o íon fluoreto, uma base dura e fraca, de um ácido duro, o próton:
|
SO32- |
+ |
HF |
|
HSO3- |
+ |
F- |
Keq = 104 |
(53) |
Do mesmo modo, o íon hidróxido, uma base dura e muito forte, pode deslocar o íon sulfito, uma base mole e mais fraca, do cátion metilmercúrio, um ácido mole:
|
OH- |
+ |
CH3HgSO3- |
|
CH3HgOH |
+ |
SO32- |
Keq = 10 |
(54) |
Nestes casos, as forças das bases (SO32- > F-; OH- > SO32-) são suficientes pára forçarem estas reações para a direita, apesar das considerações acerca de dureza-moleza. Entretanto, se ocorrer uma situação de competitividade na qual ambas, força e dureza-moleza, estão em jogo, a regra do duro-mole funciona:
|
CH3Hg-F |
+ |
H-SO3- |
|
CH3Hg-SO3- |
+ |
H-F |
Keq ~ 103 |
(55) |
|
mole-duro |
duro-mole |
mole-mole |
duro-duro |
|||||
|
CH3Hg-OH |
+ |
H-SO3- |
|
CH3Hg-SO3- |
+ |
H-OH |
Keq > 107 |
(56) |
Ao considerar as interações ácido-base, é necessário considerar ambas, a força e a dureza-moleza. A Tabela 7 contem as forças de várias bases com relação ao próton (H+) a ao cátion metilmercúrio (CH3Hg+). Bases como sulfito (S2-) e trietilfosfina (Et3P) são muito fortes com relação ao íon metilmercúrio e ao próton, mas é cerca de um milhão de vezes melhor com relação ao próton e, portanto, é dura. O íon fluoreto, F-, não é uma base particularmente boa em relação a estes ácidos, mas é ligeiramente melhor em relação ao próton como esperado devido ao seu caráter duro.
Tabela 7 - Basicidade em relação ao próton e ao cátion metilmercúrio.
|
Base |
Átomo que faz a ligação |
pKm(a), (CH3Hg+) |
pKd(b), (H+) |
|
F- |
F |
1,50 |
2,85 |
|
Cl- |
Cl |
5,25 |
-7,0 |
|
Br- |
Br |
6,62 |
-9,0 |
|
I- |
I |
8,60 |
-9,5 |
|
OH- |
O |
9,37 |
15,7 |
|
HPO4- |
O |
5,03 |
6,79 |
|
S2- |
S |
21,2 |
14,2 |
|
HOC2H4S- |
S |
16,12 |
9,52 |
|
SCN- |
S |
6,05 |
~4 |
|
SO32- |
S |
8,11 |
6,79 |
|
S2O32- |
S |
10,90 |
Negativo |
|
NH3 |
N |
7,60 |
9,42 |
|
p -NH2C6H4SO3- |
N |
2,60 |
3,06 |
|
f 2PC6H4SO3- |
P |
9,15 |
~0 |
|
Et2PC2H4OH |
P |
14,6 |
8,1 |
|
Et3P |
P |
15,0 |
8,8 |
|
CN- |
C |
14,1 |
9,14 |
(a)
pKm = log [CH3HgB] / [CH3Hg+] [B] ; (b) pKd = log [HB] / [H+] [B]A importância da acidez inerente e de um segundo fator duro - mole está bem mostrada na série de Irving - Williams e em alguns quelatos com oxigênio, nitrogênio e enxofre (Fig. 5). A série de Irving-Williams de estabilidade crescente do Ba2+ ao Cu2+ é uma medida de acidez inerente crescente do metal (em grande parte devido ao tamanho decrescente). Sobrepondo-se a isto há o fator dureza-moleza segundo o qual espécies mais moles, que vêm no final da série, (quanto maior o número de elétrons d) favorecem ligantes S > N > O. Quanto mais duro os íons de metais de transição iniciais e os alcalino terrosos (poucos ou nenhum elétron d) se ligam preferencialmente na ordem O > N > S.
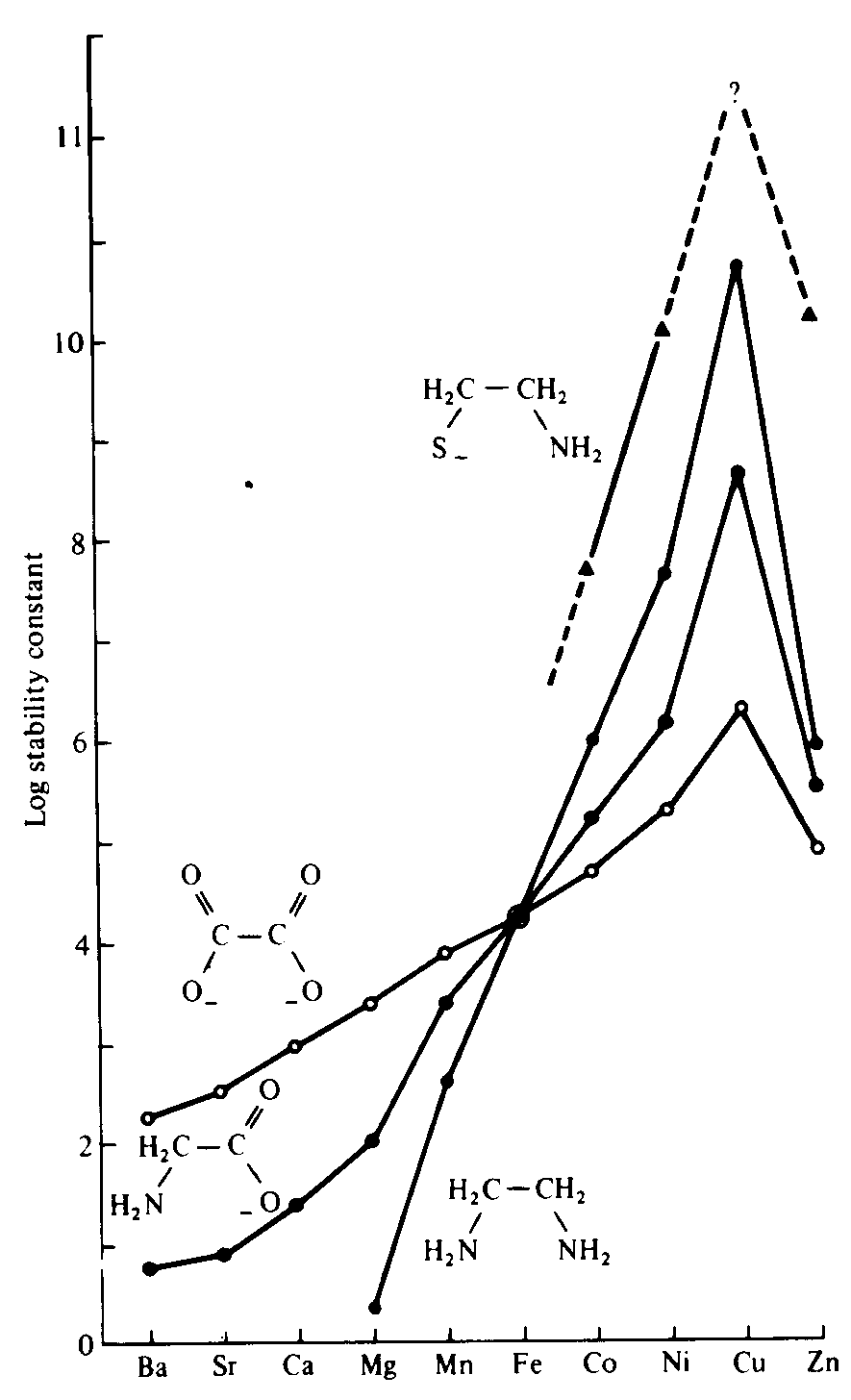
Figura 5 - O efeito Irving-Willians: a estabilidade crescente na série Ba - Cu decresce em Zn.