Efeito do pH sobre o equilíbrio metal-complexo
Muitos agentes complexantes e
quelantes são bases de Lewis (isto é, capazes de doar par de
elétrons) e também bases de Brönsted (isto é, capazes de
receber prótons) e, consequentemente, serão afetados pelas
mudanças no pH.
A reação quelatométrica é influenciada pelo pH, porque o
agente quelante não se apresenta totalmente na forma do íon
quelante livre, ou sejam os íons hidrogênio competem com o íon
metálico na quelação. Assim a formação de um complexo pode
ser descrita pela equação:
Mn+ + HyLy-m
![]() MLn-m + yH+
(1)
MLn-m + yH+
(1)
Para a qual a expressão de equilíbrio é:
| [ MLn-m ] [ H+ ]y | ||
| K= | ------------------------------ | (2) |
| [Mn+ ] [ HyLy-m ] |
a qual também pode ser interpretada, separadamente, da seguinte forma:
yH+ + L-m ![]() HyLy-m
(3)
HyLy-m
(3)
[HyL y-m ] |
||
| KHyL = | -------------------- |
(4) |
[H+]y[L-m ] |
e
M n+ + L-m à MLn-m
(5)
[MLn-m] |
||
KML = |
------------------- |
(6) |
[Mn+] [L-m] |
dividindo a expressão (6) pela (4), temos:
[MLn-m ] [H + ]y |
||
| KML / KHyL = | ---------------------- |
(7) |
[Mn+ ] [HyLy-m ] |
De onde, comparando-se com a equação de KHyL (4), pode-se tirar que:
KML |
||
| K = | -------- |
(8) |
KHyL |
onde, KHyL é a constante de estabilidade do complexo com o próton (também chamada de constante de ionização para o caso dos ácidos aminopolicarboxílicos).
Entretanto, cada etapa de ionização do ácido aminopolicarboxílico é definida por uma constante de ionização.
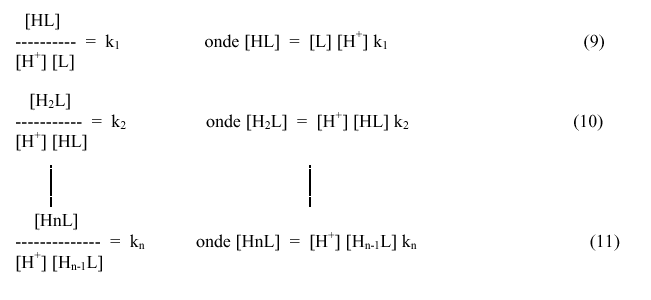
Como resultado dessa basicidade (tendência a reagir com os prótons) que os íons quelantes L apresentam, é que a formação do complexo é função do pH. Assim, a "constante de formação aparente" ou "constante de estabilidade efetiva" de um complexo em determinado pH, pode ser definida pela expressão:
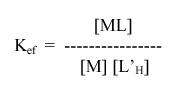
onde, [L’H] indica a concentração total do agente quelante não ligado ao metal, em determinado pH. Dessa maneira, tem-se para a concentração total de [L’H]:
[L’H] = [L] + [HL] + [H2L] + ...... + [HnL] (13)
Substituindo os valores de [HL], [H2L] etc., pelos valores dados pelas constantes parciais de ionização (9 a 11), tem-se:
[L’H]
= [L] + [L] [H+ ] k1 + [L] [H+]2
k1k2 + .... + [L] [H + ]n
k1 k2 ... kn (14)
porém, o termo [L’H] também pode ser obtido da
expressão:
[L’H] |
||
| a H = | --------- |
(15) |
[L] |
onde aH é o quociente entre a concentração total do agente quelante não ligado ao metal em determinado pH, e a concentração total do agente quelante.
[L’H] = a H [L] (16)
Substituindo-se o valor da equação (16) em (14), tem-se:
a H [L] = [L] + [L] [H + ] k1 + [L] [H + ]2 k1 k2 + .... + [L] [H + ]n k1 k2 ... kn (17)
Pode-se com o auxílio das expressões apresentadas, tirar o valor da constante de estabilidade aparente, a um determinado pH, como sendo:
K |
||
| Kef = | -------- |
(19) |
aH |
onde K é a constante de estabilidade absoluta.